2022上半年干细胞治疗行业快讯
干细胞是一类具有自我复制和多向分化能力的细胞,它们可以不断地自我更新,并在特定条件下转变成为一种或多种构成人体组织或器官的细胞。我们可以说,干细胞是机体的起源细胞,是形成人体各种组织器官的始祖细胞。因为其强大的增殖和分化能力,在器官组织修复和一些特发性疾病的治疗方面,具有无限的开发潜力。近年来,干细胞治疗一直是细胞治疗的焦点领域,行业进展日新月异,我们这里盘点了2022年的一些行业发展突破,和大家分享一下。
1、干细胞结合基因治疗在血液疾病方面的发展
2022年2月发表在新英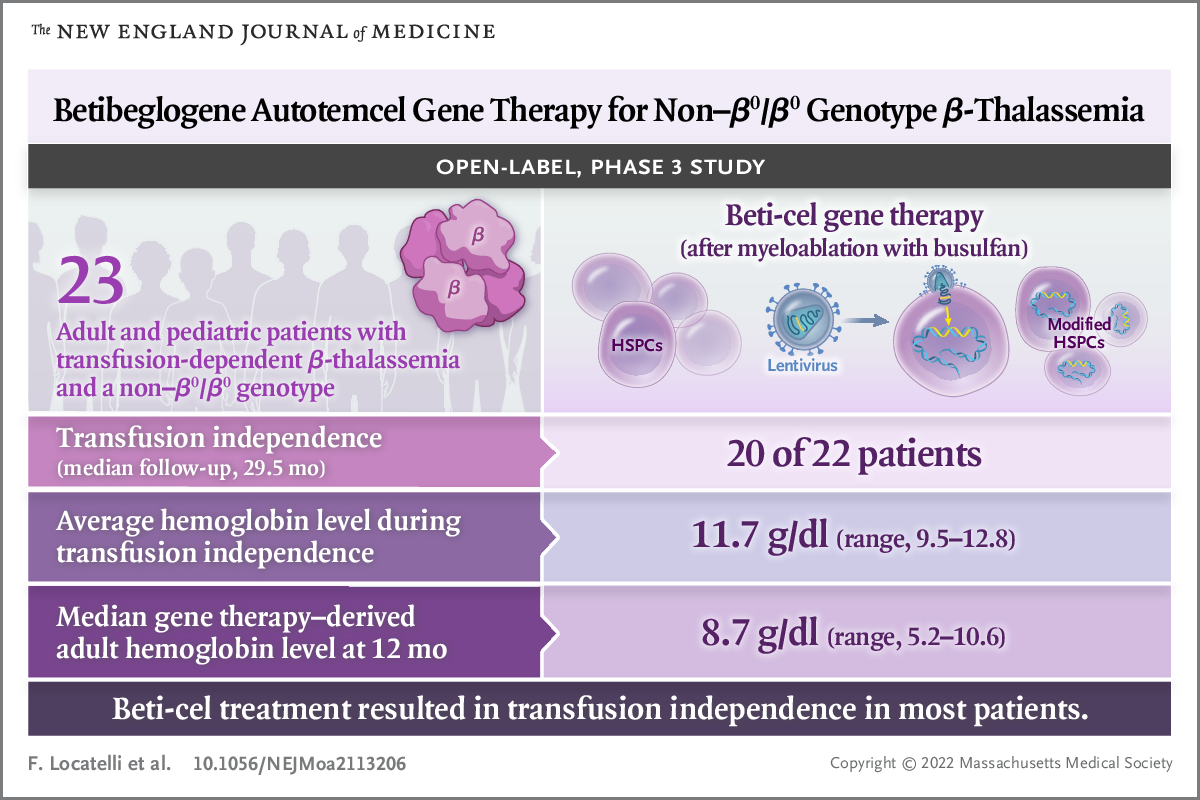 格兰杂志的一篇文章表明,使用beti-cel基因疗法可以有效治疗输血依赖性的β-地中海贫血,beti-cel包含使用BB305慢病毒转导的β-珠蛋白基因(βA-T87Q)的CD34+造血干细胞和祖细胞。这是一项开放的III期临床研究,研究者评估了beti-cel治疗输血依赖性β地中海贫血和非β0/β0基因型的患者的疗效和安全性。受试者接受了基于白消安的骨髓消融术,并静脉输注beti-cel,主要终点事件是患者不再依赖输血(停止输注红细胞≥12个月,平均血红蛋白水平≥9g/dl)。研究共纳入23例患者,中位随访时间为29.5个月,可以评估的22名患者中有20名最后不再依赖输血(91%),停止输血后的平均血红蛋白水平为11.7g/dl。beti-cel的安全性与基于白消安的骨髓消融术相同,有4例患者出现至少1次与beti-cel相关的不良事件,除了1例血小板减少症外,所有不良事件均不严重,没有观察到癌症病例。最后研究得出结论对于大多数非β0/β0基因型的患者,使用beti-cel治疗可持续使总血红蛋白水平升高,最终患者不再依赖于输血。
格兰杂志的一篇文章表明,使用beti-cel基因疗法可以有效治疗输血依赖性的β-地中海贫血,beti-cel包含使用BB305慢病毒转导的β-珠蛋白基因(βA-T87Q)的CD34+造血干细胞和祖细胞。这是一项开放的III期临床研究,研究者评估了beti-cel治疗输血依赖性β地中海贫血和非β0/β0基因型的患者的疗效和安全性。受试者接受了基于白消安的骨髓消融术,并静脉输注beti-cel,主要终点事件是患者不再依赖输血(停止输注红细胞≥12个月,平均血红蛋白水平≥9g/dl)。研究共纳入23例患者,中位随访时间为29.5个月,可以评估的22名患者中有20名最后不再依赖输血(91%),停止输血后的平均血红蛋白水平为11.7g/dl。beti-cel的安全性与基于白消安的骨髓消融术相同,有4例患者出现至少1次与beti-cel相关的不良事件,除了1例血小板减少症外,所有不良事件均不严重,没有观察到癌症病例。最后研究得出结论对于大多数非β0/β0基因型的患者,使用beti-cel治疗可持续使总血红蛋白水平升高,最终患者不再依赖于输血。
2022年2月美国阿拉巴马大学伯明翰分校的研究人员发表在新英格兰杂志的一篇名为《Biologic and Clinical Efficacy of LentiGlobin for Sickle Cell Disease》的中期报道分析了LentiGlobin治疗镰状细胞贫血的临床试验结果,LentiGlobin包含使用BB305慢病毒载体转导的β-珠蛋白基因(βA-T87Q)的自体造血干细胞和祖细胞。这是一项1-2期临床研究,研究者优化了A组的7例镰状细胞贫血患者和B组的2例镰状细胞贫血患者的治疗过程,并设立了一个C组为LentiGlobin治疗镰状细胞贫血进行关键评估。在这项中期分析中,研究者评估了C组35名患者使用LentiGlobin治疗的安全性和有效性,尤其是统计了严重不良事情的发生情况,具体是指LentiGlobin输注后24个月之内发生至少4次血管闭塞事件的患者。结果表明截至2021年2月,C组所有35名患者干细胞植入均成功,输注6个月至36个月,中位总血红蛋白水平从基线时的8.5 g/dL增加到11 g/dL,Hb-AT87Q占据了至少40%,在可评估的25名患者中,严重血管闭塞事件均得到缓解,不良事件数为平均每年3.5例,3名患者发生了与LentiGlobin相关的非严重不良事件,发病后1周内消退。在长达 37.6个月的随访期间,未观察到血液系统癌症病例。结论表明LentiGlobin可以有效治疗镰状细胞贫血,从而减少溶血的发生并完全解决了严重的血管闭塞事件。
无独有偶,英国剑桥大学的Sunita Goyal等人于2022年1月同样发表在新英格兰杂志的一篇文章报道了一例使用LentiGlobin治疗镰状细胞贫血的不良事件,此处的LentiGlobin与前文是同一种药物。作为LentiGlobin临床研究的试验组的一员,一名妇女接受了LentiGlobin治疗镰状细胞贫血,约5.5年后发生了急性髓细胞白血病。对该妇女外周血样本的分析表明,病变细胞包含BB305慢病毒载体插入位点。因果关系调查的结果表明,考虑到插入位点的位置,白血病不太可能与载体插入有关,可能是镰状细胞贫血本身、移植手术风险以及治疗后疾病控制不足所致。
2、干细胞在生殖领域的应用
2022年,Science公布了一项干细胞治疗在生殖领域的重大突破,从胚胎干细胞诱导分化产生的大鼠精子,可以使卵子受孕产生健康后代。科学家首先诱导大鼠胚胎干细胞产生上胚层样细胞,随后将产生的上胚层样细胞放在含有信号分子和其他成分的培养基中,促进它们转变为大鼠原始生殖细胞样细胞(PGCLC)。接下来,PGCLC与性腺体细胞一起培养,促进它们成熟和表观遗传重组。一旦PGCLC成熟,就被移植到一只经过改造没有生殖细胞的雄性大鼠的睾丸生精小管中,并让其自然发育为成熟的精子。随后,研究人员从这只雄性大鼠身上取出精子样本,并将它们直接注射到一只活的雌性大鼠的卵母细胞中,该雌性大鼠生下了健康的后代。他们指出,这些后代成长并能够自然繁殖。
类似的,Mary Herbert等人于2022年发表在新英格兰的一篇简讯展示了使用干细胞复制整个雌性生殖周期的过程,培养出的小鼠卵母细胞可受精。研究者把受精产生的大约200个双细胞胚胎移植到假孕母鼠子宫中,5%顺利产下活的后代。
3、干细胞在组织修复中的发展
近期,来自美国印第安纳大学医学院与阿拉巴马大学伯明翰分校等组织的研究团队,在Science Advance上面公布iPS细胞有效改善视力恢复血管健康。研究人员通过将人类诱导多能干细胞(hiPSC)分化为具有血管修复特性的特定中胚层细胞亚群,用来修复血管功能障碍的视网膜,证明了iPS技术对视网膜病变的糖尿病小鼠的保护作用,不仅改善了视网膜功能,还通过增加血管和灌注血管来修复受损血管的结构,以及有效恢复异常信号级联。该项研究为安全、有效和稳健的推导hiPSC衍生的特定细胞亚群提供了明确方案,将作为一种全新的疗法来拯救缺血组织和修复糖尿病中常见的微血管疾病患者,为他们带来了新的希望。
4、干细胞分化调控
近日,发表在《Science Advances》上的一篇名为:“Single-cell architecture and functional requirement of alternative splicing during hematopoietic stem cell formation”的文章,揭示了造血干细胞发生过程中的RNA选择性剪接。
RNA剪接是指从DNA模板链转录出的最初转录产物中除去内含子,并将外显子连接起来形成一个连续的RNA分子的过程。近期,科学家将内皮细胞分离出来,以单细胞转录组学为基础,绘制了小鼠HSC发育全程的RNA剪接图谱,并对内皮细胞向造血细胞的转变(EHT)过程中,出现的关键可变剪接及其上游调控因素进行探究,鉴定出Srsf2因子可以通过调控造血特异性RNA选择性剪接事件促进HSC发生的新机制。
2022年4月,YEON-WOO CHO等人发表于《Science Advances》上面的一篇文章揭示了一种使用单个金属-有机框架嵌入的纳米芯片:作为调控神经干细胞分化的新方法。要想自发产生多种类型的细胞,稳定供应必需的生物分子以模拟体内微环境至关重要。研究者报告了一个新平台,该平台使用嵌入了纳米颗粒的单个金属有机框架(SMENA)实现了高效的神经干细胞向神经元细胞分化,每个纳米颗粒经过特殊设计可以长期存储和释放视黄酸。SMENA平台成功地抑制了细胞间的物理相互作用,结构稳定,没有纳米颗粒介导的毒性问题。由于视黄酸的持续和长期供应,神经干细胞显示出各种与神经活动相关的mRNA表达增强。SMENA平台也可应用于其他干细胞来源和分化谱系,对于各种基于干细胞的再生疗法都有帮助。
参考文献
[1] Franco Locatelli, Alexis A. Thompson, Janet L, et al. Kwiatkowski. Betibeglogene Autotemcel Gene Therapy for Non–β0/β0 Genotype β-Thalassemia[J]. N Engl J Med, 2022; 386:415-427
[2] Julie Kanter, Mark C. Walters, Lakshmanan Krishnamurti, et al. Biologic and Clinical Efficacy of LentiGlobin for Sickle Cell Disease[J]. N Engl J Med, 2022, 386:617-628.
[3] Sunita Goyal, John Tisdale, Manfred Schmidt, et al. Acute Myeloid Leukemia Case after Gene Therapy for Sickle Cell Disease[J]. N Engl J Med, 2022, 386:138-147.
[4] Mami oikawa, Kobayashi, Makoto sanbo, et al. Functional primordial germ cell–like cells from pluripotent stem cells in rats Generating functional rate gametes[J]. SCIENCE, 2022, 376(6589):176-179.
[5] Mary Herbert, Azim Surani. Oocytes from Stem Cells[J]. N Engl J Med, 2022, 386:188-190.
[6] Chang-hyun Gil, Chakraborty, Cristiano P. Vieira, et al. Specific mesoderm subset derived from human pluripotent stem cells ameliorates microvascular pthology in type 2 diabetic mice[J]. SCIENCE ADVANCES, 2022, 8(9).
[7] Fang Wang, Puwen Tan, Pengcheng Zhang, et al. Single-cell architecture and functional requirement of alternative splicing during hematopoietic stem cell formation[J]. SCIENCE ADVANCES, 2022, 8(1).
[8] Yeon-Woo Cho, Jee, Xintan Rosalina Suhito, et al. Single metal-organic framework–embedded nanopit arrays: A new way to control neural stem cell differentiation[J]. SCIENCE ADVANCES, 2022, 8(16).



