混合SMART球体增强干细胞治疗 CNS损伤
美国新泽西州立大学2021年近期的研究结果披露,混合的SMART球体可以增强干细胞对神经损伤的治疗作用,结果发表在SCIENCE ADVANCES上面。
干细胞疗法在治疗中枢神经系统衰弱性损伤和疾病方面具有巨大潜力,但低存活率和低效分化限制了其临床应用。最近3D细胞培养方法,例如基于干细胞的细胞球体和类器官,通过模拟3D细胞-细胞相互作用已显示出优势,但是细胞-基质相互作用不足以及繁琐的制造程序降低了它们的体内治疗效果。为了解决这些问题,研究者开发了一种可生物降解的纳米材料模板3D细胞组装方法,该方法能够形成具有深度药物递送能力和3D细胞-基质相互作用的均匀结合的混合干细胞球体。因此,在脊髓损伤动物模型中证明了干细胞的高存活率、受控分化和功能恢复。总体而言,混合干细胞球体代表了材料辅助3D细胞培养系统的重大发展,可以为基于干细胞的中枢神经系统(CNS)损伤治疗铺平道路。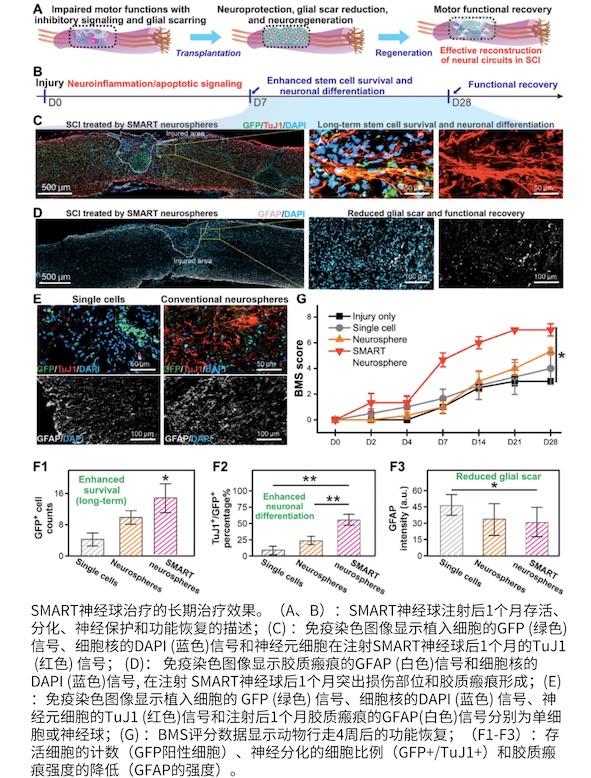
神经系统疾病,尤其是CNS损伤和疾病,由于神经再生能力有限以及神经系统中复杂的抑制性微环境,治疗非常棘手,迫切需要使用创新方法产生功能性神经细胞(主要是神经元)并重建受损的神经回路来开发可靠的神经疾病治疗方法。干细胞疗法是一种很有前途的方法,它们具有许多治疗益处,包括增殖、分化成功能性神经细胞和分泌各种免疫调节因子。几项临床前和临床研究表明,基于干细胞的离体和体内疗法在许多人类疾病方面具有巨大潜力。目前为止的研究结果表明,干细胞的中枢神经系统治疗受到存活率低、整合效率低、神经可塑性丧失和植入细胞分化不可控的严重限制,这主要归因于神经系统中高度抑制和炎症、损伤的微环境。为了解决上述问题,一种方法是使用支架材料在干细胞植入过程中产生有利的微环境,这些支架可以帮助产生三维(3D)干细胞组装,减轻局部炎症,并建立有利的细胞-细胞外基质(ECM)相互作用,通常通过粘着斑激酶(FAK)信号传导来调节神经发生和轴突伸长。
干细胞球体通常由3D细胞培养产生,基于球体的无支架干细胞疗法可以增强细胞存活和分化,并通过其仿生3D细胞-细胞相互作用刺激神经营养因子的分泌。它们还允许以准确且相对无创的方式在CNS损伤或疾病部位注射高密度干细胞,从而增强干细胞植入的治疗效果。然而,干细胞3D球体的体内转化中存在一些障碍。例如干细胞球体向特定细胞谱系(例如神经元和神经胶质细胞)的受控分化主要依赖于微环境中的自发细胞信号调控。此外,在体外长期培养过程中,氧气、营养物质和生长因子向球体核心的扩散受限通常会导致细胞凋亡,这种现象被称为“坏死核心”。鉴于基于支架和无支架球体的方法的优点和缺点,需要开发一种组合的协同方法,可以 :(i)以受控方式创建包含3D细胞-细胞和细胞-基质相互作用的混合干细胞球体;(ii)能够在疾病损伤部位的体内球体内实现受控、均匀和可监测的药物释放。
研究者开发了一种纳米生物材料介导的3D细胞组装方法来生成混合干细胞球体,其中结合了受控的细胞-基质相互作用和药物释放。在研究者的概念验证演示中,可生物降解的2D纳米材料有效地促进了人类诱导多能干细胞 (hiPSC) 衍生的神经细胞(NSC) (hiPSC-NSC)快速组装成混合3D球体。通过这种方式,研究者可以在体外和体内更好地控制球体的形成及其向功能性神经元的分化,从而改善脊髓损伤动物模型的治疗效果。
为了启动SMART神经细胞球体(简称“SMART神经球“)的形成,研究者将hiPSC-NSC的悬液与神经层粘连蛋白(ECM)-纳米材料(即γ相MnO2纳米片)溶液混合,直到细胞在10到15分钟内发生聚集。选择层粘连蛋白因为它是调节人脑中干细胞存活和神经发生的关键分子之一,选择 hiPSC-NSC是因为它们具有出色的细胞疗法临床潜力。MnO2纳米片是SMART神经球的最后也是最关键的组成部分,它具有薄原子结构以有效地结合层粘连蛋白、负表面电荷以最大限度地减少细胞吸收,以及横向尺寸(~200 nm)包含整联蛋白簇来支持粘着斑的形成。
然后,研究者试图将药物均匀输送到整个3D组织中,与SMART神经球相结合,以协同诱导hiPSC-NSCs的神经元分化。生物材料介导的受控药物递送可以弥合体外和体内微环境的不足;然而,3D球体结构中的药物扩散屏障大大限制了它们的治疗效果。SMART神经球可以通过在组装过程中加入药物来克服这些障碍。具体来说,可以首先将药物加载到MnO2纳米片上,从而促进药物在整个3D细胞组件中的均匀分布。尽管报道了许多用于诱导神经球体外分化成神经元的方法,但它们在体内的转化通常不能令人满意。Notch抑制剂的递送是研究者最感兴趣的,因为Notch信号通路具有与胶质发生的转录诱导广泛相关,DAPT通过阻止Notch细胞内结构域的切割,进而抑制Notch信号传导,导致胶质生成减少和神经元分化增加。之后,通过混合hiPSC-NSCs溶液和DAPT、层粘连蛋白、MnO2纳米片的溶液,形成具有均匀分布 Notch-i的SMART神经球。假设通过在SMART神经球核心内控制释放DAPT可以实现有效的神经元分化,为了验证假设,研究者首先检测建立了深度药物输送功能的SMART神经球在CNS损伤部位增强干细胞定植的效果,体外干细胞试验取得了令人鼓舞的结果。此外,由于智能神经球中的纳米材料(MnO2纳米片)可以被细胞分泌的物质有效降解,植入智能神经球的细胞毒性达到了最小。首先,研究者确认了MnO2纳米片在智能神经球中能否及时降解,这一点得到了注射7天后(7 DPI)深色材料明显消失的影像支持。由于MnO2纳米片的生物降解与Mn2+离子的产生有关,研究者在4周内进一步进行了尿液和血液分析,并在7 DPI(post-injection)时验证了初始生物降解(尿液样本中锰含量增加2.1倍),28 DPI时完全降解(锰含量恢复正常)。1周后,脊髓中深色MnO2支架的视觉消失也证实了这一点。接下来,研究者还研究了智能神经球是否有任何系统毒性。尽管锰存在于许多酶中,并且是人体新陈代谢的一种必需元素,但大量服用锰已被证明具有毒性。因此,研究者分析了智能神经球的植入对负责代谢和解毒的主要器官的影响,包括肾脏、肝脏、心脏、肺和脾脏。研究者对实验组的肝脏和肾脏进行了组织学检查,结果表明与对照组相比,实验组的这些主要器官切片均未显示任何明显的组织损伤迹象。总之,体内干细胞植入试验和毒性试验表明,智能神经球技术在改善干细胞治疗方面具有巨大潜力,并且毒性最小。
通过使用SMART球体,研究者可以实现对细胞-细胞和细胞-基质相互作用的有效控制以及小分子药物和生长因子的深度递送,以帮助干细胞在体外和体内的存活和分化。研究者将这项开发的技术应用于脊髓损伤模型的治疗,与对照条件相比,细胞存活、分化和神经元行为(如轴突生长)增强,显示了SMART球体的治疗潜力。混合球体的系统非常适用于任何细胞和分化类型,可用于治疗多种疾病和病症。通过创建可重复性和仿生性的3D细胞结构对类器官发育和疾病建模产生广泛影响。
参考文献:Christopher Rathnam, Letao Yang, Sofia Castro-Pedrido, et al. Hybrid SMART spheroids to enhance stem cell therapy for CNS injuriess[J]. SCIENCE ADVANCES, 2021;7 : eabj2281.
研究机构:The State University of New Jersey



