Your Current Position: 法律法规
-
2022-06-24为加强我国干细胞制剂和临床研究质量管理,国家卫生计生委与食品药品监管总局根据《干细胞临床研究管理办法(试行)》,共同组织制定了《干细胞制剂质量控制及临床前研究指导原则(试行)》。于2015年7月31日发布施行。
-
2022-06-24为指导药物临床试验申办者规范开展临床试验期间方案变更相关工作,在国家药品监督管理局的部署下,药审中心组织制定了《药物临床试验期间方案变更技术指导原则(试行)》。2022年6月23日予以颁布实行。
-
2022-06-20为落实《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》有关建立药物警戒制度的要求,指导药品监督管理部门科学规范开展药物警戒检查工作,国家药监局组织制定了《药物警戒检查指导原则》,2022年4月11日发布施行。
-
2022-06-20为鼓励罕见疾病药物研发,从临床研究方法学角度指导申办者提高研发效率,药审中心组织制定了《罕见疾病药物临床研究统计学指导原则(试行)》,2022年6月2日发布实施。
-
2022-06-14为指导抗体类药品的现场检查工作,国家药品监督管理局核查中心组织研究起草了《抗体类药品现场检查指南(征求意见稿)》,于2022年5月27日发布在药监局官网上。
-
2022-05-26为规范和指导免疫细胞治疗产品的药学研发、生产和注册,在国家药品监督管理局的部署下,药审中心组织制定了《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》。经国家药品监督管理局审查同意,2020年5月36日予发布,自发布之日起施行。
-
2022-05-26为进一步指导业界、研究者和监管机构在该领域药物的科学研发和评价,药审中心组织起草了《局部给药局部起效药物临床试验技术指导原则》。经国家药品监督管理局审查同意,2020年5月26日予发布。
-
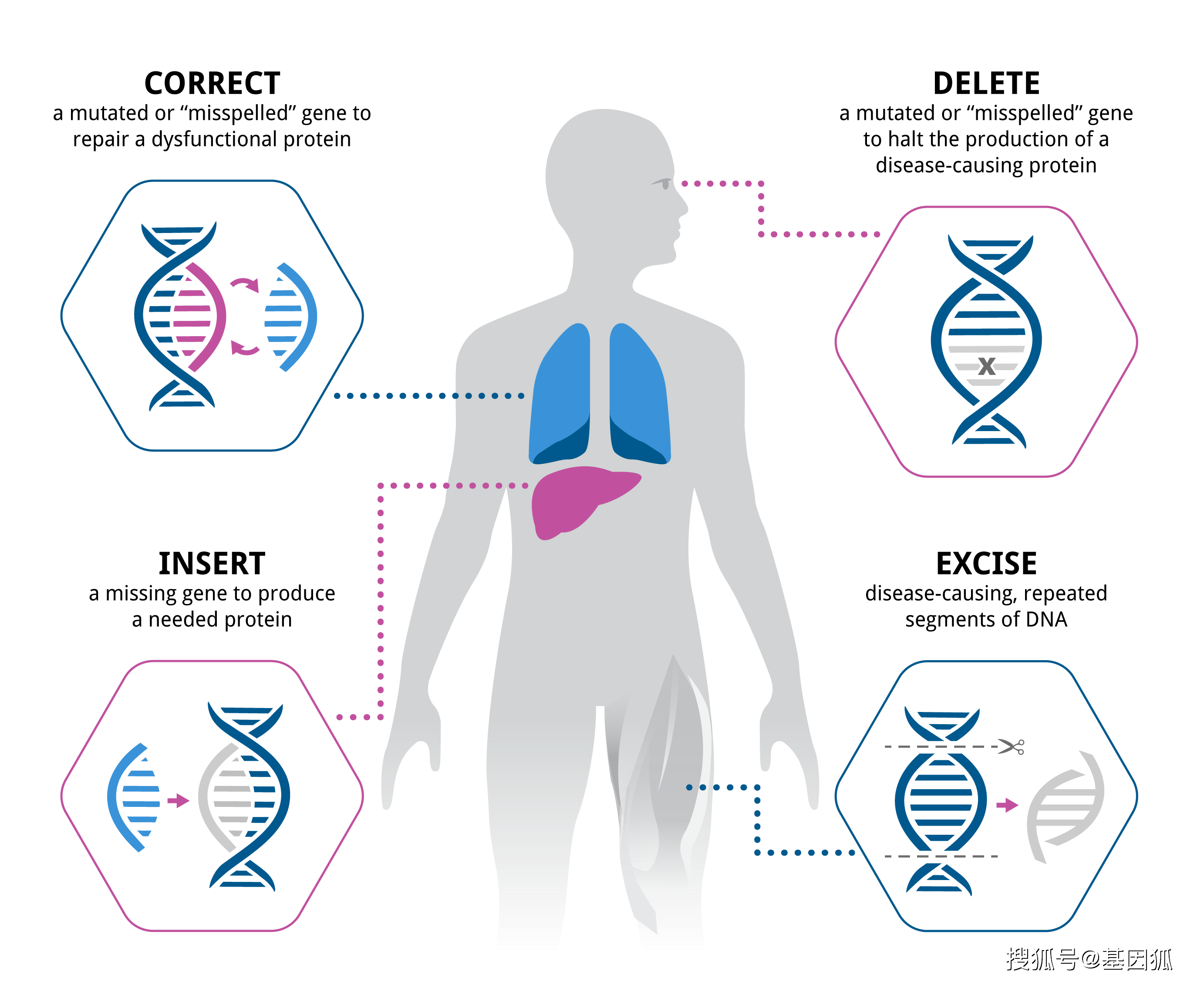
2022-05-26为规范和指导体内基因治疗产品的药学研发、生产和注册,在国家药品监督管理局的部署下,药审中心组织制定了《体内基因治疗产品药学研究与评价技术指导原则(试行)》。经国家药品监督管理局审查同意,2022年5月26日起发布施行。
-
2022-05-272022年5月27号,国家药监局关于发布《药品生产质量管理规范(2010年修订)》临床试验用药品附录,作为《药品生产质量管理规范(2010年修订)》配套文件,自2022年7月1日起施行。
-
2021-08-17为规范和引导人源性干细胞产品的药学研究,国家在前期调研的基础上,结合国内外相关法规和技术要求,以及对这类产品当前技术发展和科学的认知,形成了《人源性干细胞产品药学研究与评价技术指导原则(征求意见稿)》。